Les régulateurs européens ont initialement déclaré en juillet que les avantages du médicament ne comptaient pas sur ses risques.
Les régulateurs européens ont recommandé d’accorder une autorisation de mise sur le marché au lécanemab, un médicament contre la maladie d’Alzheimer, après un premier avis négatif plus tôt cette année.
Lecanemab, commercialisé sous le nom de Leqembi, est administré en goutte-à-goutte toutes les deux semaines.
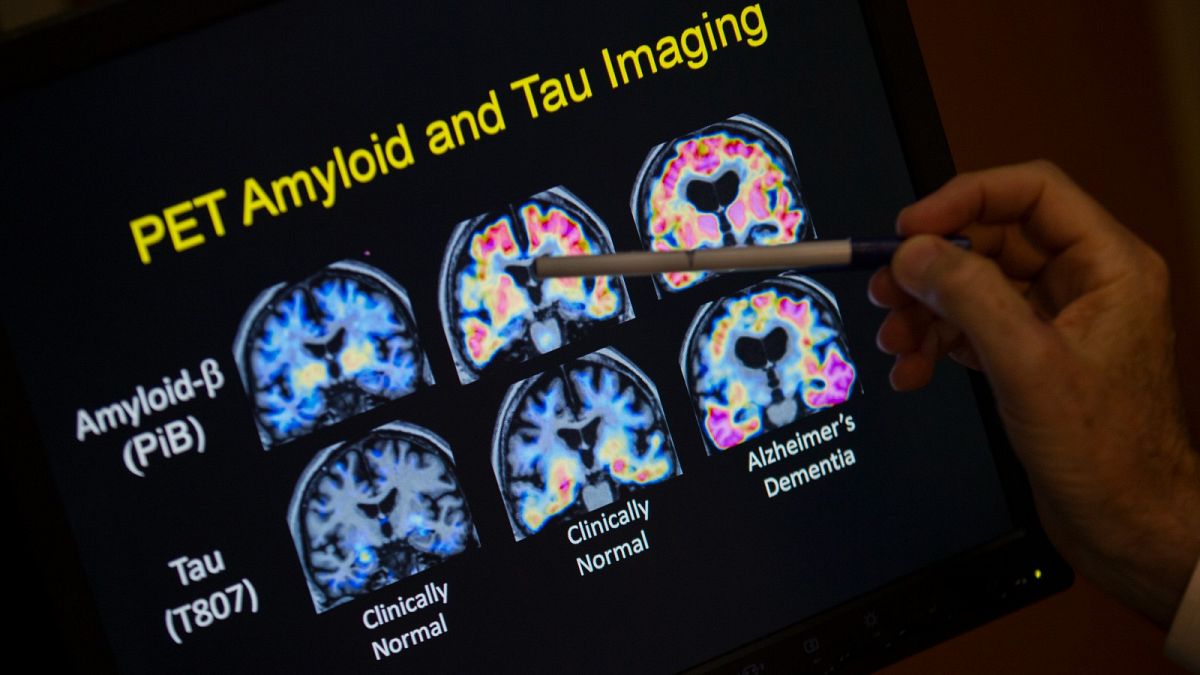
C’est un type de protéine qui se fixe à la bêta-amyloïde, une substance qui forme des plaques collantes dans le cerveau des patients atteints de la maladie d’Alzheimer.
La maladie d’Alzheimer est une maladie neurodégénérative incurable qui constitue la forme de démence la plus courante. Elle touche environ 7,8 millions de personnes dans l’Union européenne.
Leqembi a été démontré dans un essai pour ralentir le déclin cognitif lié à la maladie.
Les régulateurs de l’UE ont déclaré en juillet que les avantages potentiels du traitement pour ralentir le déclin cognitif ne compensaient pas le risque d’effets secondaires graves, notamment « un gonflement et des saignements potentiels dans le cerveau des patients » qui l’ont reçu.
Le médicament n’est autorisé que pour les personnes possédant une ou aucune copie d’un gène spécifique appelé ApoE4. La possession de ce gène est un facteur de risque connu de la maladie d’Alzheimer.
Mais les régulateurs ont déclaré que les personnes dépourvues du gène ou en possédant une seule copie risquaient moins de développer des effets secondaires que celles possédant deux copies du gène.
« Leqembi sera disponible via un programme d’accès contrôlé pour garantir que le médicament est utilisé uniquement dans la population de patients recommandée », a indiqué l’EMA, les patients étant surveillés pour détecter les effets secondaires graves grâce à des scintigraphies cérébrales.
Les régulateurs américains ont approuvé Leqembi en 2023 et l’Agence britannique de réglementation des médicaments et des produits de santé (MHRA) a approuvé le produit en août.
Cependant, le médicament n’est pas disponible sur le National Health Service (NHS) du Royaume-Uni après avoir déterminé que ses avantages étaient trop faibles pour justifier son coût.